数回にわたり、糖転移酵素の繰り返し利用について紹介してきました。糖転移酵素を樹脂等に固定化する際、結合様式は「固相樹脂に共有or非共有結合」に大別されます。前回は、酵素を利用した「共有結合」による酵素固定化法について紹介しました。今回と次回のコラムでは、「非共有結合」による酵素の固定化法について、話を進めていきます。酵素の活性を維持した状態で、酵素を樹脂等に固定化する場合、酵素活性に関与しない部位を、樹脂に固定化する必要があります。これら要件を満たす固定化酵素調製法として、酵素本来の機能を活用した事例を紹介します(Angew Chem Int Ed Engl. 2011, 50, 1328-1331. DOI: 10.1002/anie.201007153)。
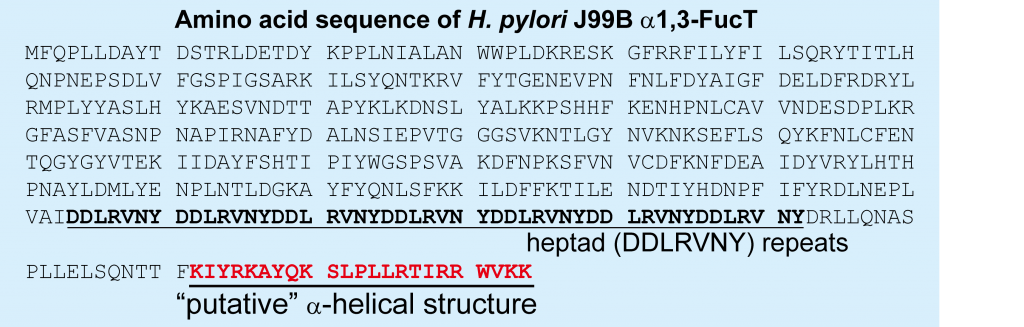
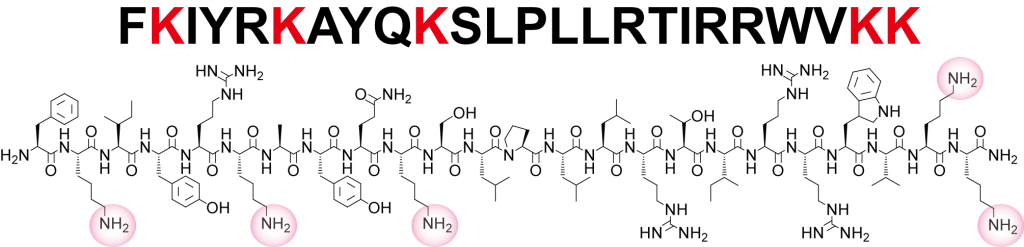
前回のコラムで出てきた Helicobacter pylori 由来1,3-Fucosyltransferase (FucT) は、C末端にSortaseA の認識する配列を遺伝子工学的に付与された構造でした。Helicobacter pylori 由来の α1,3-FucT のアミノ酸配列は下記図となります。すなわち、native α1,3-FucT の C末端には DDLRVNY の繰り返し構造である Heptad repeats と塩基性アミノ酸リッチなα-ヘリックスと推定される構造が存在します。
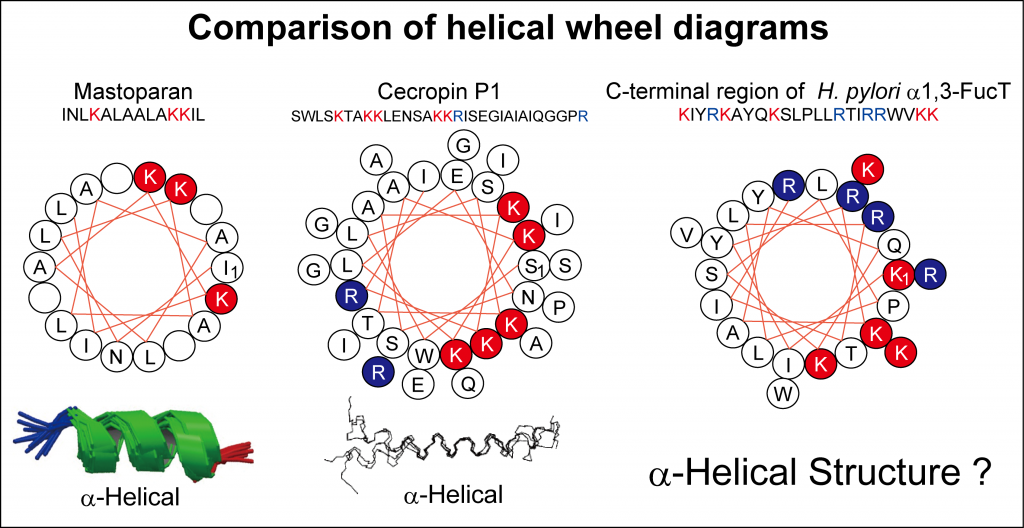
α1,3-FucT の C末端の塩基性リッチなペプチド配列を Helical Wheel Diagram で記述すると、他のα-ヘリックス構造とわかっているペプチドと同様に、片側に塩基性アミノ酸が収束することがわかります(下図)。
α1,3-FucT は、Heptad repeats を介してダイマー化し、α-ヘリックス構造を介して膜に接着していると考えられています(下図)。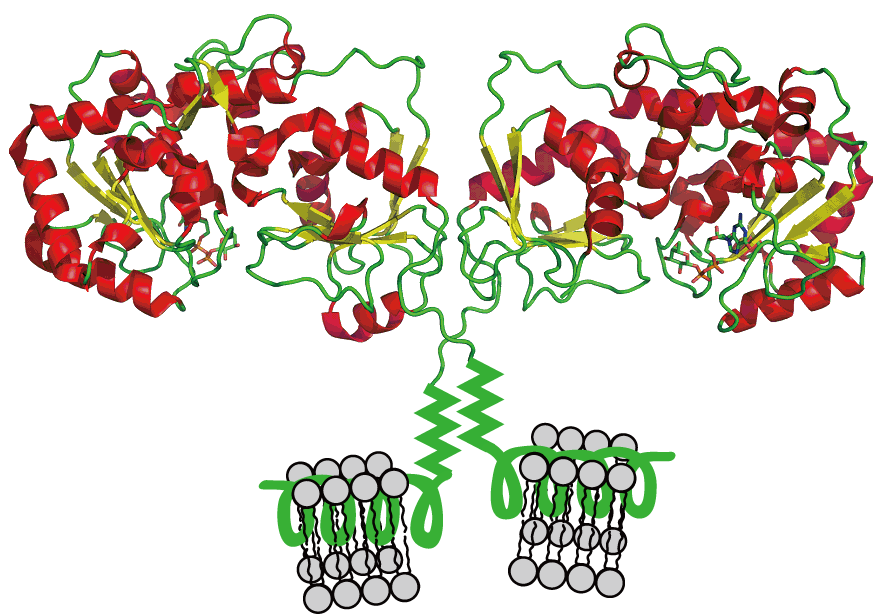
Helicobacter pylori α1,3-FucT は、アミノ酸配列から上記のように推定されていました。”推定”であったことの理由は、全長配列をレコンビトタンパク質として発現、精製ができていなかった、ということでした。全長配列で精製できなかった理由は、不溶性タンパク質として可溶化できなかったことによります。よって、Helicobacter pylori α1,3-FucT のX線結晶構造解析による構造は、 Heptad repeats以下の配列は除去された形で解かれました。
次回のコラムでは、全長配列 Helicobacter pylori α1,3-FucT の本来の機能を活用した固定化と様々な複合糖質合成への利用について紹介します。
弊社では、熟練した技術と豊富な経験、知識を持った研究員による受託解析サービス、合成サービスを実施しております。熟練した技術に基づく分析サンプル調製、HPLC、質量分析、NMR などの機器を駆使することで、種々の目的に応じた解析に対応しています。受託合成においては、蓄積した各種知見、ノウハウなどを駆使し様々なターゲットの合成実績がございます。まずはお気軽に御相談ください。ご予算に応じてベストなご提案をさせていただきます。

筆者プロフィール
naruken
博士(理学)北海道大学大学院理学研究科
専門:糖鎖工学、タンパク質工学、構造解析